Проект Національного переліку лікарських засобів: чим лікуватимуть українців?
Відповідно до Положення про Національний перелік основних лікарських засобів, затвердженого наказом МОЗ України від 11.02.2016 р. № 84, структура та зміст Національного переліку базуються на останньому виданні Базового переліку основних лікарських засобів, рекомендованих Всесвітньою організацією охорони здоров’я (далі — Базовий перелік ВООЗ). Базовий перелік ВООЗ містить економічно доцільні лікарські засоби з доведеною клінічною ефективністю, безпекою і переглядається міжнародними експертами ВООЗ раз на 2 роки.
Чинний Національний перелік базується на 19-му виданні Базового переліку основних лікарських засобів, рекомендованих ВООЗ. Однак у квітні 2017 р. ВООЗ опублікувало 20-те видання Базового переліку, у зв’язку із чим Експертним комітетом з відбору та використання основних лікарських засобів (далі — Експертний комітет) було ініційовано зміни до Національного переліку. Окрім цього, Експертним комітетом рекомендовано також включити до Національного переліку нові лікарські засоби за міжнародними непатентованими назвами (МНН), які:
- включені в державні програми та субвенції на інгаляційні засоби для наркозу і рекомендовані до включення до Національного переліку за процедурою «fast-track»;
- можуть закуповуватися за рахунок медичної субвенції для надання екстреної (невідкладної) медичної допомоги та рекомендовані до включення в Національний перелік за процедурою «fast-track»;
ПОРІВНЯННЯ З БАЗОВИМ ПЕРЕЛІКОМ ВООЗ
У порівнянні з 20-м виданням Базового переліку ВООЗ у проект Національного переліку не увійшло більше 50 МНН (табл. 1). Деякі з цих препаратів рекомендовані ВООЗ для лікування захворювань, які відмічаються в окремих регіонах світу, однак більшість ліків може застосовуватися скрізь.
| № з/п |
МНН |
| 1 | Artesunate + pyronaridine tetraphosphate |
| 2 | Ascorbic acid |
| 3 | Asparaginase |
| 4 | Atazanavir + ritonavir |
| 5 | Aztreonam |
| 6 | Bedaquiline |
| 7 | Benznidazole |
| 8 | Bevacizumab |
| 9 | Calcium |
| 10 | Cholera vaccine |
| 11 | Coal tar |
| 12 | Colecalciferol |
| 13 | Daclatasvir |
| 14 | Darunavir |
| 15 | Dasabuvir |
| 16 | Dasatinib |
| 17 | Dihydroartemisinin + piperaquine phosphate |
| 18 | Dolutegravir |
| 19 | Efavirenz + lamivudine + tenofovir |
| 20 | Eflornithine |
| 21 | Ergocalciferol |
| 22 | Glucose with sodium chloride |
| 23 | Hepatitis A vaccine |
| 24 | HPV vaccine |
| 25 | Influenza vaccine (seasonal) |
| 26 | Iodine |
| 27 | Isoniazid + pyridoxine + sulfamethoxazole + trimethoprim |
| 28 | Lamivudine + nevirapine + zidovudine |
| 29 | Ledipasvir + sofosbuvir |
| 30 | Lopinavir + ritonavir |
| 31 | Melarsoprol |
| 32 | Meningococcal meningitis vaccine |
| 33 | Mesna |
| 34 | Natamycin |
| 35 | Nicotinamide |
| 36 | Nicotine replacement therapy (NRT) |
| 37 | Nifurtimox |
| 38 | Nilotinib |
| 39 | Ombitasvir + paritaprevir + ritonavir |
| 40 | Pyridoxine |
| 41 | Retinol |
| 42 | Riboflavin |
| 43 | Rotavirus vaccine |
| 44 | Simeprevir |
| 45 | Sodium fluoride |
| 46 | Sofosbovir + velpatasvir |
| 47 | Suramin sodium |
| 48 | Thiamine |
| 49 | Tigecycline |
| 50 | Tioguanine |
| 51 | Trastuzumab |
| 52 | Typhoid vaccine |
| 53 | Ulipristal |
| 54 | Valganciclovir |
| 55 | Varicella vaccine |
| 56 | Whole blood |
При цьому до проекту Національного переліку включено деякі МНН, які відсутні в переліку ВООЗ (табл. 2). Більшість із цих препаратів рекомендується для включення Експертним комітетом за процедурою «fast-track»
| № з/п |
МНН |
| 1 | Севофлуран (Sevoflurane) |
| 2 | Саквінавір (Saquinavir) |
| 3 | Інтерферон альфа-2b (Interferon alfa-2b) |
| 4 | Такролімус (Tacrolimus) |
| 5 | Мікофенолова кислота та її солі (Mycophenolic acid) |
| 6 | Бортезоміб (Bortezomib) |
| 7 | Гозерелін (Goserelin) |
| 8 | Екземестан (Exemestane) |
| 9 | Епірубіцин (Еріrubісіn) |
| 10 | Ідарубіцин (Idarubicin) |
| 11 | Летрозол (Letrozole) |
| 12 | Мелфалан (Melphalan) |
| 13 | Мітоксантрон (Mitoxantrone) |
| 14 | Темозоломід (Тemozolomide) |
| 15 | Топотекан (Тopotecan) |
| 16 | Трипторелін (Triptorelin) |
| 17 | Фактор коагуляції крові людини VIII та фактор Віллебранда людини (Von Willebrand factor and coagulation factor VIII in combination) |
| 18 | Декстран 1 (Dextran 1) |
| 19 | Декстран 40 (Dextran 40) |
| 20 | Дилтіазем (Diltiazem) |
| 21 | Силденафіл (Sildenafil) |
| 22 | Декспантенол (Dexpanthenol) |
| 23 | Йопамідол (Iopamidol) |
| 24 | Менотропін (Human menopausal gonadotrophin) |
| 25 | Трипторелін (Triptorelin) |
| 26 | Фолтропін альфа (Follitropin alfa) |
| 27 | Соматропін (Somatropin) |
| 28 | Інтерферон бета-1а (Interferon beta-1a) |
| 29 | Інтерферон бета-1b (Interferon beta-1b) |
| 30 | Ботулінічний токсин типу А (Botulinum toxin) |
| 31 | Аміаку розчин концентрований (Ammonia) |
| 32 | Гідроксиетилкрохмаль (Hydroxyethylstarch) |
| 33 | Диклофенак (Diclofenac) |
| 34 | Дротаверин (Drotaverine) |
| 35 | Метамізол натрію (Metamizole sodium) |
| 36 | Натрію хлорид + калію хлорид + кальцію хлорид (Sodium chloride + Potassium chloride + Calcium chloride) — складний розчин |
| 37 | Оксибупрокаїн (Oxybuprocaine) |
| 38 | Теофілін (Theophylline) |
| 39 | Фенілефрин (Phenylephrine) |
ПОРІВНЯННЯ З ПОПЕРЕДНЬОЮ РЕДАКЦІЄЮ ДОКУМЕНТА
Чинний Національний перелік налічує 367 МНН лікарських засобів. У проект Національного переліку пропонується включити ще 54 МНН (табл. 3).
| № з/п |
МНН |
| 1 | Аміаку розчин концентрований (Ammonia) |
| 2 | Бортезоміб (Bortezomib) |
| 3 | Ботулінічний токсин типу А (Botulinum toxin) |
| 4 | Будесонід + формотерол (Formoterol and budesonide) |
| 5 | Вориконазол (Voriconazole) |
| 6 | Гідроксиетилкрохмаль (Hydroxyethylstarch) |
| 7 | Гозерелін (Goserelin) |
| 8 | Даптоміцин (Daptomycin) |
| 9 | Декспантенол (Dexpanthenol) |
| 10 | Диклофенак (Diclofenac) |
| 11 | Дилтіазем (Diltiazem) |
| 12 | Дротаверин (Drotaverine) |
| 13 | Екземестан (Exemestane) |
| 14 | Епірубіцин (Epirubicin) |
| 15 | Епоетин альфа, бета та тета, дарбeпоетин альфа, метоксипропіленгліколь-епоетин бета та їх відповідні біосиміляри (Epoetin alfa, beta and theta, Darbepoetin alfa, Methoxy polyethylene glycol- epoetin beta,and their respective biosimilars) |
| 16 | Золедронова кислота (Zoledronic acid) |
| 17 | Ідарубіцин (Idarubicin) |
| 18 | Інтерферон альфа-2b (Interferon alfa-2b) |
| 19 | Інтерферон бета-1b (Interferon beta-1b) |
| 20 | Інтерферон бета-1а (Interferon beta-1a) |
| 21 | Ітраконазол (Itraconazole) |
| 22 | Йопамідол (Iopamidol) |
| 23 | Каптоприл (Captopril) |
| 24 | Клонідин (Clonidine) |
| 25 | Колістин (Colistin) |
| 26 | Ламотригін (Lamotrigine) |
| 27 | Лейпрорелін (Leuprorelin) |
| 28 | Летрозол (Letrozole) |
| 29 | Лозартан (Losartan) |
| 30 | Мелфалан (Melphalan) |
| 31 | Менотропін (Human menopausal gonadotrophin) |
| 32 | Меропенем (Meropenem) |
| 33 | Метамізол натрію (Metamizole sodium)* |
| 34 | Мікофенолова кислота та її солі (Mycophenolic acid) |
| 35 | Мітоксантрон (Mitoxantrone) |
| 36 | Натрію хлорид + калію хлорид + кальцію хлорид (Sodium chloride + Potassium chloride + Calcium chloride) — складний розчин |
| 37 | Оксибупрокаїн (Oxybuprocaine) |
| 38 | Піперацилін + тазобактам (Piperacillin and enzyme inhibitor) |
| 39 | Ралтегравір (Raltegravir) |
| 40 | Севофлуран (Sevoflurane) |
| 41 | Силденафіл (Sildenafil) |
| 42 | Соматропін (Somatropin) |
| 43 | Такролімус (Tacrolimus) |
| 44 | Темозоломід (Тemozolomide |
| 45 | Теофілін (Theophylline) |
| 46 | Терліпресин (Terlipressin) |
| 47 | Топотекан (Тopotecan) |
| 48 | Трипторелін (Triptorelin) |
| 49 | Фактор коагуляції крові людини VIII та фактор Віллебранда людини (Von Willebrand factor and coagulation factor VIII in combination) |
| 50 | Фенілефрин (Phenylephrine) |
| 51 | Фентаніл (Fentanyl) |
| 52 | Фолітропін альфа (Follitropin alfa) |
| 53 | Фосфоміцин (Fosfomycin) |
| 54 | Цефепім (Cefepime) |
Таким чином, до проекту Національного переліку включено 421 МНН лікарських засобів. За підсумками 2016 р., загальні обсяги аптечного продажу та госпітальних закупівель лікарських засобів, які пропонується включити до Національного переліку, становлять 15 млрд грн. та 355,3 млн упаковок.
ЩО МОЖНА ЗАКУПОВУВАТИ?
Як відомо, з 1 січня 2018 р. заклади охорони здоров’я, які фінансуються з державного бюджету, зобов’язані закуповувати лікарські засоби, включені до Національного переліку. Після задоволення на 100% потреби в препаратах з Національного переліку заклади охорони здоров’я зможуть закуповувати інші лікарські засоби, зареєстровані в Україні.
Як вже повідомлялося, до проекту Національного переліку включено 421 МНН лікарських засобів. Однак серед цих препаратів, в Україні зареєстровано тільки 345 МНН. Тобто перелік препаратів, які зможуть закуповуватися за бюджетні кошти, значно менший.
Окрім того, відповідно до постанови КМУ від 2 липня 2014 р. № 240 «Питання декларування зміни оптово-відпускних цін на лікарські засоби та вироби медичного призначення» декларуванню зміни оптово-відпускних цін підлягають лікарські засоби, які закуповуються та/або вартість яких відшкодовується за бюджетні кошти, крім наркотичних і психотропних лікарських засобів, прекурсорів, діючих речовин (субстанцій), медичних газів та лікарських форм, які виготовляються в аптеках за рецептами лікарів (магістральними формулами) та на замовлення лікувально-профілактичних закладів.
Тобто заклади охорони здоров’я можуть закуповувати лише ті лікарські засоби, на які задекларовано оптово-відпускну ціну. Станом на 8 грудня 2017 р. в Україні зареєстровано 6512 торгових назв препаратів з урахуванням форми випуску, дозування та кількості в упаковці, які включені до проекту Національного переліку.
Оптово-відпускна ціна відповідно до постанови КМУ № 240 задекларована на 2509 препаратів. При цьому для близько 35 МНН взагалі не задекларовано оптово-відпускні ціни. Тобто закуповувати за бюджетні кошти можна буде близько 310 МНН та 2500 препаратів.
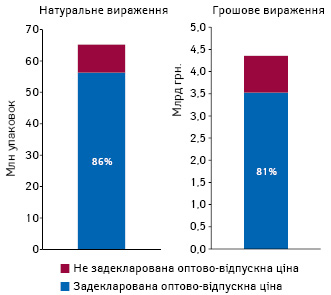
За нашими розрахунками, обсяги споживання препаратів, включених до проекту Національного переліку, за підсумками 2016 р., у госпітальному сегменті становили 4,4 млрд грн. Частка препаратів, які включені до проекту Національного переліку та на які задекларовано оптово-відпускну ціну, становить 86% в натуральному та 81% у грошовому вираженні (рисунок).
Однак проблема навіть не в кількості лікарських засобів, які зможуть закуповуватися закладами охорони здоров’я, а у визначенні потреби в них.
На сьогодні Порядок визначення обсягів потреби в закупівлі лікарських засобів закладами й установами охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, затверджено наказом МОЗ України від 11.07.2017 р. № 782 «Про затвердження Порядку визначення обсягів потреби в закупівлі лікарських засобів закладами й установами охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів». Цей порядок передбачає два методи кількісної оцінки потреби в лікарських засобах, зокрема метод, що базується на показниках захворюваності, та метод, що базується на показниках споживання. Потреба в лікарських засобах може визначатися за допомогою одного або комбінації двох методів кількісної оцінки.
Оцінити обсяги фінансування за показниками захворюваності неможливо, оскільки на сьогодні в Україні відсутні реєстри пацієнтів.
Тому обсяг фінансування, необхідний для задоволення потреби в лікарських засобах, включених до проекту Національного переліку, можна визначити лише за обсягами споживання.
Як вже зазначалося, обсяги споживання лікарських засобів, включених до проекту Національного переліку, за підсумками 2016 р., у госпітальному сегменті становили 4,4 млрд грн., а обсяги препаратів, на які задекларована оптово-відпускна ціна, — 3,5 млрд грн. Враховуючи середній приріст споживання на рівні 20%, отримуємо, що мінімальні обсяги фінансування на 2018 р. для закупівлі препаратів, на які задекларовано оптово-відпускні ціни, становитимуть 5,1 млрд грн.
ВИСНОВКИ
Для запровадження нових підходів до формування потреби у лікарських засобах необхідний достатній перехідний період для закладів охорони здоров’я, принаймні півроку, адже застосовність методики, запропонованої МОЗ, не доведено.
Оскільки процедура формування Національного переліку недостатньо чітко артикульована регулятором, то вона є непрозорою, а її наслідки — непрогнозованими.
При створенні Національного переліку фахівці Експертного комітету зберегли структуру Базового переліку ВООЗ. Така структура суттєво ускладнює статистичний облік. На нашу думку, необхідно додатково розробити перелік за торговими назвами з урахуванням статистичних класифікацій — АТС-класифікації та МКХ-10.



